Profesor: Francisco Sánchez Villarreal
Alumno: Christian Cardoza Arrunátegui
1. ¿Cuáles son las definiciones que tiene el átomo desde su descubrimiento?
Al descubrirse …
*-* Dentro de la filosofía de la antigua Grecia, la palabra átomo se empleaba para referirse a la parte más pequeña de materia y era considerada indestructible. De hecho, átomo significa en griego “no divisible”.
Según Demócrito ...
*-* Todas las cosas están compuestas de partículas diminutas, indivisibles e indestructibles a las que llamó atoma, “indivisible”.
Hoy …
*-* Es la menor cantidad de un elemento químico que tiene existencia propia, y que no es posible dividir mediante procesos químicos.
*-* Es la menor porción de un elemento la cual no tiene carga eléctrica, y puede entrar en combinaciones químicas.
*-* La parte más pequeña en que puede dividirse la materia.

Citas y Referencias Bibliográficas
1. Rincón del Vago. Átomo. Historia e investigadores. Demócrito. (Ref.08/03/07). Disponible en la siguiente Web: http://html.rincondelvago.com/atomo_historia-e-investigadores.html#
2. Aula el Mundo. El Átomo. (Ref.08/03/07). Disponible en la siguiente Web: http://aula.elmundo.es/aula/laminas/lamina1071138344.pdf
3. Aula el Mundo. El Átomo y la Tabla Periódica. (Ref.08/03/07). Disponible en la siguiente Web: http://aula.elmundo.es/aula/laminas/lamina954170837.pdf
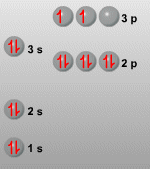
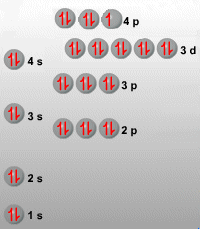
2. ¿Cuáles son elementos del átomo y como y quien los descubrió?
Antiguamente se creía que el átomo, como bien lo dice su significado era indivisible, pero en la actualidad ya conocemos que los átomos no son indivisibles, sino que están formados por tres partículas:
Electrón: Es una partícula elemental con carga eléctrica negativa igual a 1,602 x 10 (elevado a menos 19) coulomb y que forma parte de los átomos de todos los elementos.
Protón: Es una partícula elemental con carga eléctrica positiva igual a 1,602 x 10 (elevado a menos 19) coulomb y cuya masa es 1.837 veces mayor que la del electrón, que se encuentra formando parte de los átomos de todos los elementos.
Neutrón: Partícula elemental eléctricamente neutra y de masa ligeramente superior a la del protón, que se encuentra formando parte de los átomos de todos los elementos.
*-* No hubo exactamente un personaje que haya descubierto los elementos del átomo, pero quien notó algo raro en el átomo fue el químico francés Becquerel, en el año 1896, quien observó que los compuestos del metal uranio emitían radiaciones especiales, invisibles, pero que velaban las placas fotográficas.
*-* el tiempo se fueron descubriendo otras partículas subatómicas, estas son:
Bosón | - Partícula atómica o subatómica, de espin entero o nulo. - Cumple los postulados de la estadística de Bose-Einstein e incumple el principio de exclusión de Pauli. |
Electrón | - Es una partícula elemental con carga eléctrica negativa igual a 1,602 x 10 (elevado a menos 19) coulomb. - Forma parte de los átomos de todos los elementos. |
Fermión | - Partícula elemental caracterizada por su momento angular intrínseco o espín. |
Hadrón | - Partícula subatómica compuesta de quarks, caracterizada por relacionarse mediante interacciones fuertes. |
Leptón | - Un Leptón es un fermión fundamental sin carga hadrónica o de color. |
Mesón | - Partículas elementales sometidas a interacciones fuertes, de espín nulo o entero y carga bariónica nula. |
Positrón | - Partícula elemental de masa y espín iguales a los del electrón y cuya carga eléctrica es también igual a la de éste pero de signo contrario (positiva). |
Protón
| - Partícula nuclear con carga positiva igual en magnitud a la carga negativa del electrón. - La masa de un protón es de 1,6726 × 10-27 kg, aproximadamente 1.836 veces la del electrón. |
Neutrino | - Partícula nuclear elemental eléctricamente neutra y de masa muy inferior a la del electrón (posiblemente nula). - El neutrino es un fermión; su espín es 1/2. |
Neutrón
| - Partícula sin carga que constituye una de las partículas fundamentales que componen la materia. - La masa de un neutrón es de 1,675 × 10-27 kg, aproximadamente un 0,125% mayor que la del protón. |
Quark
| - Los quarks son fermiones de espín 1/2 que interaccionan electrodébilmente y fuertemente con otras partículas.
|
Citas y Referencias Bibliográficas
1. Educastur. Recursos del profesor. (Ref.08/03/07). Disponible en la siguiente Web: http://web.educastur.princast.es/cursos/cursowqp/aplic/Marcelino%20Alvarez/SUBPROCESO%20EQUIPO%20B.htm
2. Aula el Mundo. El Átomo y la Tabla Periódica. (Ref.08/03/07). Disponible en la siguiente Web: http://aula.elmundo.es/aula/laminas/lamina954170837.pdf
3. Otras partículas atómicas y subatómicas. (Ref.08/03/07). Disponible en la siguiente Web: http://perso.wanadoo.es/chyryes/glosario/otraspar.htm
3. ¿Cómo ha sido la evolución en el tiempo del átomo?
Con la aparición de la ciencia experimental en los siglos XVI y XVII, los avances en la teoría atómica se hicieron más rápidos. Los químicos se dieron cuenta de que todos los líquidos, gases y sólidos pueden descomponerse en sus constituyentes últimos o elementos.
La concepción del átomo que se ha tenido a lo largo de la historia ha variado de acuerdo a los descubrimientos realizados en el campo de la física y la química. A continuación se hará una exposición de los modelos atómicos propuestos por los científicos de diferentes épocas.
Tanto el avance de la ciencia como el descubrimiento de otros científicos aportaron a la evolución del estudio del átomo. Algunos de estos científicos fueron:
Descubrimiento de las partículas fundamentales
|
Año | Científico | Descubrimiento |
| John Dalton |
Estableció las primeras bases científicas de la teoría atómica. Demostró que los átomos se unían entre si en proporciones definidas (moléculas) según cada elemento y por medio de una fuerza eléctrica (enlace químico) y que todos los átomos de un elemento presentan las mismas características. (propiedades químicas)

|
1897 | J.J. Thomson (1856-1940) |
Demostró la existencia de los electrones dentro de los átomos. Dedujo que el átomo debía ser una esfera de materia cargada positivamente, en cuyo interior estaban incrustados los electrones. Modelo atómico de Thomson.

|
1911 | E. Rutherford (1871-1937) |
Demostró que los átomos no eran macizos, sino que estaban vacíos en su mayor parte. En su centro (núcleo) residían los protones, partículas con carga idéntica a los electrones, pero positivas. Pensó que los electrones, en número igual al de los protones, debían girar alrededor del núcleo en órbitas circulares. Modelo atómico de Rutherford.
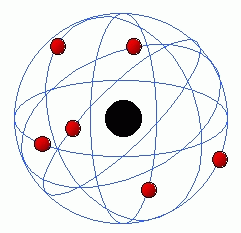
|
1913 | N. Bohr (1885-1962) |
Propuso un nuevo modelo atómico en el que los electrones giraban alrededor del núcleo en unos niveles bien definidos, donde dichos niveles sólo podían albergar un número limitado de electrones. Modelo atómico de Bohr.

|
1932 | J. Chadwick (1891-1974) |
Descubrió una nueva partícula fundamental en los átomos, el neutrón, partícula sin carga eléctrica, con masa muy parecida a la de los protones y que se encontraban también en el núcleo.

|
Citas y Referencias Bibliográficas
1. Rincón del Vago. El átomo. (Ref.12/03/06). Disponible en la siguiente Web: http://html.rincondelvago.com/atomo_4.html
2. Enciclopedia Wikipedia en español. El Átomo. Proceso evolutivo del Átomo. (Ref.12/03/06). Disponible en la siguiente Web:
http://es.wikipedia.org/wiki/Ãtomo
4. ¿Qué se entiende por energía nuclear y como se clasifica?
*-* La energía nuclear es aquella que resulta del aprovechamiento de la capacidad que tienen algunos isótopos de ciertos elementos químicos para experimentar reacciones nucleares y emitir energía en la transformación.
*-* Una reacción nuclear consiste en la modificación de la composición del núcleo atómico de un elemento, que muta y pasa a ser otro elemento como consecuencia del proceso. Este proceso se da espontáneamente entre algunos elementos y en ocasiones puede provocarse mediante técnicas como el bombardeo neutrónico u otras.
Clasificación...
Fisión:
*-* En la actualidad es utilizado en las centrales nucleares. Cuando un átomo pesado (como por ejemplo el Uranio o el Plutonio) se divide o rompe en dos átomos más ligeros, la suma de las masas de estos últimos átomos obtenidos, más la de los neutrones desprendidos es menor que la masa del átomo original, luego se verifica la fórmula de Albert Einstein E=MC2, con lo que se desprende Energía.

Fusión:
*-* La fusión nuclear, está actualmente en líneas de investigación, debido a que todavía hoy no es un proceso viable, ya que se invierte más energía en el proceso para que se produzca la fusión, que la energía obtenida mediante este método.
*-* La fusión, es un proceso natural en estrellas, produciéndose reacciones nucleares por fusión debido a la elevadísima temperatura de estas estrellas, que están compuestas principalmente por Hidrógeno y Helio.
Citas y Referencias Bibliográficas 1. Enciclopedia Libre Wikipedia en español. Energía nuclear. (Ref.12/03/06). Disponible en la siguiente Web: http://es.wikipedia.org/wiki/EnergÃa_nuclear
2. La energía nuclear. Trabajo colgado en geocities. (Ref.12/03/06). Disponible en la siguiente Web: http://www.geocities.com/paraisonuclear/
5. ¿Que es radioactividad y que son radiacciones, como se clasifican y como afectan al hombre?
Radioactividad:
*-* La radioactividad es un fenómeno físico natural, por el cual algunas sustancias o elementos químicos llamados radiactivos, emiten radiaciones que tienen la propiedad de impresionar placas fotográficas, ionizar gases, producir fluorescencia, atravesar cuerpos opacos a la luz ordinaria, etc. Debido a esa capacidad se las suele denominar radiaciones ionizantes (en contraste con las no ionizantes). Las radiaciones emitidas pueden ser electromagnéticas en forma de rayos X o rayos gamma, o bien partículas, como pueden ser núcleos de Helio, electrones o positrones, protones u otras.
La radiactividad puede ser:
- Natural: Manifestada por los isótopos que se encuentran en la naturaleza.
- Artificial o inducida: Manifestada por radioisótopos producidos en transformaciones artificiales.
*-* En Física, la radiación es un modo de propagación de la energía a través del espacio, de forma análoga a la luz.
*-* Todo material emite radiación electromagnética, cuya intensidad dependera de la temperatura a la que se encuentre.
*-* Estas radiaciones pueden ser de tres clases principales: alfa, beta y gamma. La primera está formada por partículas pesadas y tiene carga eléctrica positiva; la segunda consiste en partículas ligeras cargadas negativamente y la tercera es electromagnética con una naturaleza similar a la luz.

*-* Las radiaciones gamma son las más penetrantes y para detenerlas se necesitan gruesas paredes de concreto o acero. Las radiaciones beta se detienen con una delgada lámina de metal (por ejemplo papel de aluminio). La radiación alfa se detiene con una simple hoja de papel; son tan poco penetrantes que no pueden atravesar la piel del hombre.
*-* Todos los seres, tanto humanos como animales, pueden recibir una cierta dosis de radiación sin consecuencias. Sin embargo, si las dosis recibidas son muy altas, pueden producir enfermedades. (mayormente a la piel.)
*-* A lo largo del día el hombre recibe una considerable dosis de radiación del sol, de minerales que hay en la tierra y hasta de las propias pantallas de televisión.

Citas y Referencias Bibliográficas
1. Enciclopedia libre Wikipedia en español. Radioactividad. (Ref.13/03/06). Disponible en la siguiente Web: http://es.wikipedia.org/wiki/Radioactividad
2. Comisión Federal de Electricidad. ¿Qué es la energía nuclear?. (Ref.13/03/06). Disponible en la siguiente web: Página Web
6. ¿Porque todos los cuerpos emiten radiaciones y esta radiación es constante?
*-* Ciertos núcleos pertenecientes sobre todo a isótopos no muy abundantes o creados artificialmente son inestables, y para alcanzar su estabilidad emiten radiaciones.
*-* Los núcleos radioactivos pierden con el tiempo su actividad. Por otra parte, las radiaciones son absorbidas por la materia, incluso por el aire y disminuyen según nos alejamos de las fuentes. Por sus propiedades, estas radiaciones se pueden eliminar con facilidad empleando blindajes adecuados que las absorban.




Citas y Referencias Bibliográficas
1. Comisión Federal de Electricidad. ¿Qué es la energía nuclear?. (Ref.13/03/06). Disponible en la siguiente web: Página Web
7. ¿Cuáles son los efectos que produciría una explosión nuclear?
Las bombas convencionales causan solamente un efecto destructivo provocado por la onda de choque, mientras que las nucleares tienen muchos, siendo estos los principales:
*-* El primero de estos efectos es que la radioactividad liberada en caso de holocausto penetraría en todos y cada uno de los seres vivos (y en el mar, la tierra y el aire). Mientras que en dosis altas (según la especie) produciría la muerte, en otras más bajas los efectos serían de lo más variados (mutaciones, esterilidad...)

*-* El segundo sería que los materiales impulsados por las detonaciones se elevarían hasta la troposfera donde ocultarían la luz del sol durante meses o años, haciendo bajar la temperatura de la tierra y alterando la fotosíntesis de los vegetales y el plancton marino: sería el famoso invierno nuclear. Además estos materiales radiactivos irían cayendo durante meses o años convirtiéndose en una lluvia radiactiva global que, aún con menos dosis radiactiva que una lluvia provocada por una bomba, sería global.

*-* El tercero sería una reducción en la capa de ozono producida por el óxido de nitrógeno generado por las bolas de fuego, de modo que la radiación solar que llegase a la tierra sería mortal. Un 70% del ozono desaparecería en el hemisferio norte y un 40% en el sur, siendo necesarios 30 años para recuperar su estado normal.

*-* Las consecuencias de una explosión nuclear dependen en gran medida no sólo de la potencia del arma, sino también de la altura a la que se detona y del área que se ve afectada.
*-* Un megatón es bastante potente si se lo compara con los 0'015 megatones de la bomba lanzada sobre Hiroshima, que causó más de 120.000 bajas. Si la detonación se produce a una altura tal que la bola de fuego no toque el suelo (unos 2.500 m.) el pulso térmico alcanzará a más personas y los edificios destruidos lo estarán en un radio más amplio; sin embargo, si detona cerca del suelo la bola de fuego vaporizaría todos los materiales que se encontraran dentro de ella y los elevaría cientos de metros para dejarlos caer luego en una amplia zona como lluvia radiactiva que produciría muchas más bajas que la explosión en sí, prolongando su agonía durante semanas.

*-* La bola de fuego iluminaría la escena durante los 30 seg. que tardaría en apagarse, llegando hasta los 4 Km. de diámetro y que ascendería como un cohete hasta apagarse a más de 9 Km. de altura, mientras durase freiría todo lo que se encontrase bajo ella.
*-* Tras la explosión los supervivientes presentarían un aspecto infernal: amputación de miembros, quemaduras por todo el cuerpo, confusión por no saber qué ha ocurrido, desesperación por encontrar a los seres queridos...
Citas y Referencias Bibliográficas
1. Energía nuclear. Efectos de una explosión nuclear. (Ref.13/03/06). Disponible en la siguiente Web: http://www.arrakis.es/~lallave/nuclear/efectos.htm
2. Energía nuclear. Efectos de una explosión nuclear. Ejemplos. (Ref.13/03/06). Disponible en la siguiente Web:http://www.arrakis.es/~lallave/nuclear/ejemplo1.htm
8. ¿Qué es mecánica cuántica y a que se refiere con la teoría de los cuantos?
*-* Es la ciencia que estudia el comportamiento de la matería en proporciones muy pequeñas.
*-* La mecánica cuántica describe el estado instantáneo de un sistema (estado cuántico) con una función de ondas que codifica la distribución de probabilidad de todas las propiedades medibles, u observables. Algunos observables posibles sobre un sistema dado son la energía, posición, momento y momento angular.
*-* La mecánica cuántica no asigna valores definidos a los observables, sino que hace predicciones sobre sus distribuciones de probabilidad. Las propiedades ondulatorias de la materia son explicadas por la interferencia de las funciones de onda.
*-* Técnicamente, se la llama mecánica cuántica porque convierte en «cuantos» fijos las energías posibles del electrón en el átomo, así como otras magnitudes incluido el espín.
*-* Max Planck demostró que un átomo radiante no despide su energía continua, sino discontinuamente, a golpes. La mismísima emisión de radiaciones y no sólo nuestro conocimiento del hecho-es un fenómeno estadístico. La teoría de los cuantos obligaba a formular toda ley como una ley estadística, el determinismo no resultaba así más que una antigualla supersticiosa.
Citas y Referencias Bibliográficas
1. Enciclopedia libre Wikipedia en español. Mecánica Cuántica. (Ref.13/03/06). Disponible en la siguiente Web: http://es.wikipedia.org/wiki/Mecánica_cuántica
2. El búho. José Biedma. Física cuántica´, lógica y causalidad. (Ref.13/03/06). Disponible en la siguiente Web: http://aafi.filosofia.net/NOCTUA/noctua23.htm
9. ¿Cómo se podría utilizar la energía nuclear en la alimentación?
*-* La ciencia y la tecnología cada día nos sorprenden más y más. Ahora se ha desarrollado la técnica del empleo de las radiaciones ionizantes para la conservación de alimentos, alargar de su período de consumo, y reducción de las pérdidas causadas por insectos después de la recolección. La técnica del tratamiento de alimentos con energía ionizante consiste en exponer los alimentos a una dosis de radiación gamma predeterminada y controlada. Esta técnica consume menos energía que los métodos convencionales y puede reemplazar o reducir radicalmente el uso de aditivos y fumigantes en los alimentos, lo cuál es muy frecuente en la región Piura.
*-* El proceso es frío, en consecuencia, los alimentos tratados conservan la frescura (pescado, frutas, verduras) y su estado físico (comestibles congelados o secos). La técnica elimina del alimento envasado los agentes causantes de su deterioro, como bacterias, hongos, insectos, etc., evitando la recontaminación. (Piura, siendo una ciudad donde el calor perdura todo el año, le es conveniente adoptar esta técnica)
*-* La irradiación impide los brotes en tubérculos y raíces comestibles; impide la reproducción de insectos y parásitos; inactiva bacterias, esporas y mohos; y retrasa la maduración de frutas. Esta técnica es aceptada y recomendada por la FAO, OMS y el OIEA.

Citas y Referencias Bibliográficas
1. Energía Nuclear. (Ref. 13/03/06). Página disponible en la siguiente Web: http://centros6.pntic.mec.es/cea.pablo.guzman/lecciones_fisica/energia_nuclear.htm
10. ¿Que es espectroscopía?
*-* La espectroscopia es la ciencia que estudia el espectro luminoso de los cuerpos, con aplicaciones en química, física y astronomía, entre otras disciplinas científicas. El análisis espectral en el cual se basa, permite detectar la absorción o emisión de radiación electromagnética de ciertas energías, y relacionar estas energías con los niveles de energía implicados en una transición cuántica.

Espectro de luz de una flama de mechero
11. ¿Qué es una mezcla y cuantos tipos de mezcla hay y que son soluciones?
*-* Es una combinación física formada por dos o más componentes, los cuales no tienen una proporción fija o definida. En una mezcla cada componente conserva inalterable sus propiedades físicas y químicas. Las mezclas se pueden separar por medios físicos.
*-* Presentan temperatura variable durante los cambios de estado.
Las mezclas se clasifican en homogeneas y heterogenas, según esten constituidas por una fase o mas. Una fase es la porción de materia que tiene las mismas características y que es físicamente diferente de la otra porción de materia con la cual está en contacto.
*-* Mezclas Homogéneas: (también llamadas soluciones)
Tienen apariencia uniforme y solo se ven como una sola fase. Presentan iguales propiedades en todos sus puntos. Se separan por cristalización, extracción, destilación y cromatografía.
Estas mezclas se conocen más genéricamente como soluciones. Una solución está constituida por un “solvente”, que es el componente que se halla en mayor cantidad o proporción y uno o más “solutos”, que son las sustancias que se hallan dispersas homogéneamente en el solvente. El solvente universal es el agua, puede estar a una proporcion de 40/60 y el agua continua siendo el solvente en esa mezcla.
*-* Mezclas Heterogéneas:
Presentan un aspecto no uniforme. Se separan por filtración, decantación y por separación magnética. Están formadas por dos o más sustancias puras que se combinan, conservando cada una sus propiedades particulares, de tal manera que podemos distinguir las sustancias que la componen. En las Mezclas heterogéneas podemos distinguir cuatro tipos de mezclas:
-_- Coloides: son aquellas formadas por dos fases sin la posibilidad de mezclarse los componentes (Fase Sol y Gel)
-_- Sol: Estado diluido de la mezcla, pero no llega a ser liquido, tal es el caso de la mayonesa, las cremas, espumas, etc.
-_- Gel: Estado con mayor cohesión que la fase Sol, pero esta mezcla no alcanza a ser un estado solido como por ejemplo la jalea.
-_- Suspensiones: Mezclas heterogéneas formadas por un sólido que se dispersan en un medio líquido.
Citas y Referencias Bibliográficas
1. Enciclopedia libre Wikipedia en español. Mezcla. (Ref. 15/03/06). Página disponible en la siguiente Web: http://es.wikipedia.org/wiki/Mezcla
12. ¿Qué es un compuesto y cuales son sus tipos ?
*-* En química, un compuesto es una sustancia formada por la unión de dos o más elementos químicos. Una característica esencial es que tiene una fórmula química. Por ejemplo, el agua es un compuesto formado por hidrógeno y oxígeno en la razón de dos a uno.
*-* Los elementos de un compuesto no se pueden dividir o separar por procesos físicos (decantación, filtración, destilación, etcétera), sino sólo mediante procesos químicos.
Los compuestos se dividen en tres grandes ramas:
-_- Binarios: Son aquellos que tienen 2 electrones; destacan el Ácido, Óxido anhídrido, Sal, Peróxido, Hidruro.
-_- Terciarios: Son aquellos que tienen 3 electrones; destacan Orto, Meta, Piro.
Cuaternarios: Son aquellos que tienen 4 electrones; en esta rama están comprendidos los radicales.
Citas y Referencias Bibliográficas
1. Enciclopedia libre Wikipedia en español. Compuesto químico. Compuesto químico. (Ref. 15/03/06). Página disponible en la siguiente Web: http://es.wikipedia.org/wiki/Compuesto_quÃmico
13. ¿Cuál es la diferencia entre una mezcla y un compuesto?
*-* Para llegar a diferenciar las mezclas de los compuestos, tomenos en cuenta que en una mezcla las sustancias que llamamos componentes conservan sus propiedades características, y se pueden separar con cierta facilidad, mientras que en los compuestos las sustancias se combinan en proporciones fijas y dan lugar a un nuevo producto con propiedades diferentes a las de sus componentes y no se pueden separar por medios físicos. Se deberían proponer algunos ejemplos para ver que si hay cambio sustancial (reacción química) en un proceso como, por ejemplo, comparar las propiedades de una mezcla de azufre y hierro, antes de calentarlos, con las del sulfuro de hierro obtenido después de calentar fuertemente la mezcla inicial.
Ejemplos de compuestos:
*-* Es un compuesto químico llamado hipoclorito de sodio (NaCIO) disuelto en agua. Fue desarrollado por el francés Berthollet en 1787 y utilizado en un principio para el blanqueo de telas.

*-* El ozono es un compuesto inestable de tres átomos de oxígeno, el cual actúa como un potente filtro solar evitando el paso de una pequeña parte de la radiación ultravioleta (UV) llamada B que se extiende desde los 280 hasta los 320 manómetros (nm).

Citas y Referencias Bibliográficas
1. Materiales y sustancias ordinarias: propiedades y transformaciones. (Ref.22/03/07). Disponible en la siguiente Web: http://www.oei.org.co/fpciencia/art17.htm
14. ¿Que usos tienen los procesos físico químicos?
La reutilización de aguas residuales urbanas es una práctica muy extendida en numerosos países áridos o semiáridos de manera que hoy día este tipo de aguas ha entrado a formar parte del ciclo hidrológico y a ser consideradas como recursos hídricos alternativos que deben ser tenidos en cuenta en todo balance. La depuración previa de estas aguas, en sus diferentes niveles, mejora su calidad y abre notablemente las posibilidades de su utilización. Por otra parte, la reutilización cumple un segundo objetivo que es evitar su vertido a cauces o al mar en donde pueden tener algunos efectos indeseables, como la eutrofización, malos olores, impacto visual, etc.. o la propia contaminación directa de otras aguas.
Los fenómenos físicos y químicos más frecuentes que dan lugar a la depuración del agua infiltrada son: filtración, adsorción, absorción, cambio iónico, precipitación, coprecipitación de metales pesados con carbonatos, sulfuros e hidróxidos, hidrólisis y descomposición microbiológica aerobia y anaerobia. Los procesos que contribuyen más a la mejora de la calidad del agua son los aerobios pues son más eficaces, rápidos y no suelen dar lugar a sustancias indeseables.
Citas y Referencias Bibliográficas
1. Lección 28. Reutilización de aguas residuales. Aspectos teóricos. Requisitos previos. Procesos físico-químicos. Efectos secundarios. Precauciones. (Ref.17/03/07). Disponible en al siguiente web: http://www.agua.uji.es/pdf/leccionRH28.pdf
15. ¿Que son sistemas biológicos, cuales son ?
Un sistema biológico es más que una asociación de células que cumplen, en su conjunto una función básica del organismo
La población (o demo) es un sistema biológico formado por un grupo de individuos de la misma especie que viven en un lugar determinado en un momento determinado. Aproximadamente, la especie es un conjunto de individuos semejantes que transmiten este parecido de generación en generación.
La comunidad (o biocenosis) es un sistema biológico que agrupa el conjunto de poblaciones habitantes de un mismo lugar determinado, en unas condiciones dadas del medio y en un momento concreto.
El individuo (organismo) es un sistema biológico funcional que, en los casos más simples, se reduce a una sola célula (unicelular), pero que, en principio, está compuesto por numerosas células, que pueden estar agrupadas en tejidos y órganos. Un individuo se caracteriza por su anatomofisiología y su metabolismo. En un momento dado, un individuo posee una determinada biomasa que se puede expresar en peso vivo (fresco) o en peso de materia seca.
Citas y Referencias Bibliográficas
1. Educación Ambiental. Elementos de la ecología. Niveles de Integraciónde los Materiales Biológicos. (Ref.17/03/07). Disponible en la siguiente Web: http://www.jmarcano.com/nociones/niveles.html
16. ¿Cómo esta compuesto el átomo de carbono y que papel cumple en la química y en los seres vivos?
El átomo de carbono, debido a su configuración electrónica, presenta una importante capacidad de combinación. Los átomos de carbono pueden unirse entre sí formando estructuras complejas y enlazarse a átomos o grupos de átomos que confieren a las moléculas resultantes propiedades específicas. La enorme diversidad en los compuestos del carbono hace de su estudio químico una importante área del conocimiento puro y aplicado de la ciencia actual.
pesar de su aparición tardía en la historia de la química, la química de los compuestos del carbono es en la actualidad la rama de las ciencias químicas que crece con mayor rapidez. La variedad de productos derivados del carbono puede resultar prácticamente ilimitada debido a las propiedades singulares de dicho átomo y, por tanto, constituye una fuente potencial de nuevos materiales con propiedades especiales, de medicamentos y productos sanitarios, de colorantes, de combustibles, etc. Algunos de estos ejemplos son considerados a continuación.
La materia viviente es, en parte, materia constituida por derivados del carbono. Las transformaciones que sufren los seres vivos, y que observamos a simple vista, se corresponden, desde un punto de vista submicroscópico o molecular, con cambios o reacciones químicas de las sustancias biológicas. Azúcares, grasas, proteínas, hormonas, ácidos nucleicos, son algunos ejemplos de sustancias, todas ellas compuestos del carbono, de cuya síntesis y degradación en el interior de los organismos vivos se ocupa la bioquímica.
Medicamentos
El mundo de los medicamentos ha constituido en el pasado y constituye en la actualidad una parte importante de la investigación y el desarrollo de productos derivados del carbono. Su importancia en orden a mejorar la esperanza de vida de los seres humanos y sus condiciones sanitarias hace de este área del conocimiento científico una herramienta imprescindible para la medicina. Pero, ¿por qué los medicamentos son, por lo general, compuestos orgánicos? ¿Cuál es el origen de este hecho?
Los fármacos actúan en el organismo a nivel molecular y es precisamente el acoplamiento entre la molécula del fármaco y el receptor biológico, es decir, el sitio de la célula o del microorganismo sobre el cual aquél actúa, el último responsable de su acción curativa. Pero para que ese acoplamiento sea posible ambos agentes, fármaco y receptor, tienen que presentar una cierta complementariedad tal y como sucede con una cerradura y su correspondiente llave. Los receptores biológicos suelen ser moléculas de gran tamaño y por este motivo son las cadenas carbonadas de los compuestos orgánicos las que pueden poseer una estructura geométrica que mejor se adapte a la porción clave del receptor; tal hecho, junto con la presencia de grupos funcionales con acciones químicas definidas, son responsables de la abundancia de sustancias orgánicas entre los productos farmacéuticos.
Polímeros orgánicos
Los polímeros orgánicos son compuestos formados por la unión de dos o más unidades moleculares carbonadas idénticas que reciben el nombre de monómeros. La unión de dos monómeros da lugar a un dímero, la de tres a un trímero, etc.
Los polímeros pueden llegar a contener cientos o incluso miles de monómeros, constituyendo moléculas gigantes o macromoléculas.
Existen en la naturaleza diferentes sustancias que desde un punto de vista molecular son polímeros, tales como el caucho o las proteínas; pero en el terreno de las aplicaciones los más importantes son los polímeros artificiales. Su síntesis en los laboratorios de química orgánica ha dado lugar a la producción de diferentes generaciones de nuevos materiales que conocemos bajo el nombre genérico de plásticos. La sustitución de átomos de hidrógeno de su cadena hidrocarbonada por otros átomos o grupos atómicos ha diversificado las propiedades de los plásticos; la investigación en el terreno de los polímeros artificiales ha dado como resultado su amplia implantación en nuestra sociedad, sustituyendo a materiales tradicionales en una amplia gama que va desde las fibras textiles a los sólidos resistentes.
Citas y Referencias Bibliográficas
1. Rincón del Vago. Átomo de carbono. (Ref.18/03/07). Disponible en la siguiente Web: http://html.rincondelvago.com/carbono.html#
17. ¿Qué son fenómenos físico moleculares y cual es su relación con los procesos biológicos?
*-* Hoy en día distinguimos dos clases de fenómenos, los físicos, que no alteran la sustancia de los cuerpos y, lo químicos, que sí las alteran. Dentro de los fenómenos físicos se encuentran los físico moleculares que tienen la misma definición de fenómeno físico pero agregandole que para realizar un proceso biológico se necesita de una fuerza molecular que la impulse. El clásico ejemplo del fenómeno físico molecular es el agua, que al ser helada se convierte en hielo, en ambos estados sigue siendo agua; pero si se hace arder el carbón, éste se combina con el oxígeno del aire y forma un nuevo cuerpo, que llamamos anhídrido carbónico.
*-* Si dividimos y seguimos subdividiendo, un trozo de materia llegaríamos a una porción muy pequeña, eso sí, en esta porción la materia conservaría todas sus propiedades. Es lo que llamamos moléculas. Por tanto, podemos considerar los cuerpos como una suma de conglomerados de moléculas y, si ellas están muy juntas, forman un cuerpo sólido; en cambio si están en distancias intermedias forman un líquido. Esto se debe a que actúan dos fuerzas moleculares -la cohesión, fuerza atractiva que puja por unirlas, y la repulsión, fuerza disgregadora, que tiende a separarlas. Y es lógico pensar que en los cuerpos sólidos hay un predominio de la cohesión, en cambio, en el gaseoso la fuerza que manda es la repulsión, mientras que en los líquidos hay una nivelación de ambas fuerzas moleculares.
Citas y Referencias Bibliográficas
1. Conocimientos elementales. Físico-Químicas. (Ref.21/03/07). Disponible en la siguiente Web: http://j.orellana.free.fr/textos/fisico.htm